Engenharia genética/As DNA polimerases Taq e Pfu
Considerações iniciais
[editar | editar código-fonte]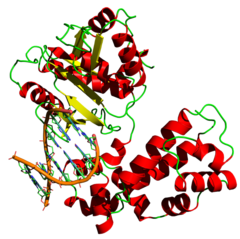
Um grande número de DNA polimerases de seres termófilos e hipertermófilos têm sido isoladas e caracterizadas de archaea e eubacterias termófilas.
Estas enzimas têm atividade a uma temperatura ótima elevada e têm uma estabilidade térmica que corresponde aos ambientes térmicos extremos onde os organismos vivem.
Apesar do facto de a estabilidade térmica das proteínas nativas variar entre as diversas enzimas, existe uma temperatura ótima de polimerização comum entre os 70 e os 80ºC.
Isto sugere que a estabilidade do template, contrastando com a estabilidade intrínseca das enzimas, determina a temperatura da polimerização.
Devido à termoestabilidade destas enzimas, as relações entre a estrutura e função, e as potenciais aplicações biotecnológicas de muitas destas enzimas termoestáveis, tal como as DNA polimerases, são de grande interesse para a investigação científica.
Taq DNA polimerase
[editar | editar código-fonte]A Taq DNA polimerase é proveniente da bactéria termófila Thermus aquaticus, sendo a enzima de eleição para a maioria das aplicações de PCR (Polymerase Chain Reaction). A Taq DNA polimerase consiste numa cadeia polipeptídica simples, com um peso molecular de aproximadamente 95 kD e com uma temperatura ótima de atividade de 75 ºC. Esta DNA polimerase catalisa a síntese do DNA de 5'-3'. Por outro lado, de 3'-5' não tem atividade exonucleásica e de 5'-3' esta é baixa. A enzima é obtida a partir de células de Escherichia coli nas quais está clonado o gene poI de Thermus aquaticus. Através da técnica de PCR, a Taq polimerase é usada para amplificar fragmentos de DNA tão grandes como 5 Kb e apresenta uma taxa de erro de 2.2x10-5 nucleótidos por ciclo.



Pfu DNA polimerase
[editar | editar código-fonte]A Pfu DNA polimerase, enzima encontrada no organismo hipertermófilo Pyrococcus furiosus, tem a menor taxa de erro conhecida na amplificação por PCR. Por essa razão, é usada nas aplicações de PCR que exigem grande fidelidade.
A enzima catalisa a incorporação de nucleótidos na direcção 5'-3' na presença de magnésio a 70-80ºC.
Esta é obtida a partir de células de Escherichia coli nas quais está clonado o gene poI de Pyrococcus furiosus.
A Pfu DNA polimerase tem atividade exonucleásica de 3'-5', o que lhe permite corrigir erros introduzidos durante a polimerização. Esta DNA polimerase tem a capacidade de efetuar proofreading, consequentemente, a sua taxa de erro é cerca de 7 a 10 vezes menor do que a da Taq polimerase (esta última não é capaz de efectuar proofreading). Apresenta uma taxa de erro inferior a 2.6x10-6 por nucleótido em cada ciclo.
No entanto, a Pfu tem a desvantagem de ser mais lenta e requerer 1 a 2 minutos para amplificar 1 kb de DNA a 72ºC.
Esta enzima pode aceitar nucleótidos com marcadores fluorescentes como substrato e não tem atividade detectável de transcriptase reversa. Quando utilizada em técnicas de PCR, gera produtos amplificados blunt-end.
Sumário
[editar | editar código-fonte]Para a amplificação de fragmentos de DNA, através do método de PCR, têm sido muito úteis as DNA polimerases Taq e Pfu.
O microrganismo Escherichia coli está geneticamente bem caracterizado, tem crescimento rápido e é de fácil cultivo, consequentemente, apresenta um rendimento significativo na produção destas polimerases.
Neste trabalho, as DNA polimerases foram isoladas a partir de Thermus aquaticus (Taq) e de Pyrococcus furiosus (Pfu) e, posteriormente, foram expressas em E. coli.
