Sistemas Sensoriais/Fisiologia da dor
Introdução - o que é a dor?
[editar | editar código-fonte]A dor é definida como uma "desagradável experiência sensorial e emocional, associada a lesão ou potencial lesão tecidular, ou descrita em termos de lesão" pela Associação Internacional do Estudo da Dor (International Association for the Study of Pain IASP). A dor é, para além disto, uma experiência sensorial complexa essencial à sobrevivência. Os mecanismos através dos quais o sistema nervoso central (SNC) detecta estímulos com potencial de lesão tecidular são indispensáveis para provocar processos e comportamentos que protegem o tecido de lesões presentes e lesões adicionais. Estes estímulos nocivos incluem forças mecânicas intensas, extremos de temperatura e exposição a químicos ou deprivação de oxigénio.
Tipos de dor
[editar | editar código-fonte]De forma geral, a dor pode ser dividida em duas categorias: aguda ou crónica.
Características típicas da dor aguda são o seu início súbito e uma duração total dos sintomas inferior a seis meses. A patologia por detrás da dor é muitas vezes facilmente identificada, visto que a dor aguda é frequentemente bem localizada e definida através dos tecidos danificados. Por outro lado, a dor aguda costuma desaparecer com a paragem da lesão e regeneração do tecido lesionado.
A dor crónica, por sua vez, persiste após o processo de regeneração ter ocorrido. Pode ou não sinalizar um processo de lesão tecidular continuado e está muitas vezes associado a uma resposta neurológica ou psicológica disfuncional. Muitos doentes com dor crónica têm uma longa história de tratamentos farmacológicos sem sucesso e mostram muitas comorbilidades e outros sintomas tais como depressão, revolta, frustração, diminuição do nível de actividade e redução do sono.
A dor também pode ser classificada de acordo com o tipo de danos que a provoca. Duas grandes categorias serão então a dor nociceptiva, causada por lesão tecidular, e a dor neuropática, causada por lesão neuronal. As subcategorias típicas, as características e os mecanismos destes tipos de dor encontram-se listados na tabela 1. Uma terceira categoria muito discutida é a dor psicogénica, que muitas vezes é causada por lesão tecidular ou nervosa, mas é prolongada por factores psicológicos como medo, depressão, stress e ansiedade. Casos de dor exclusivamente psicológica são raros.
| Tipos de dor | Características | Mecanismos |
|---|---|---|
| Nociceptiva
- Somática (lesão tecidular) - Visceral - Inflamatória (musculoesqueletal) |
Constante ou tipo cólica, dificilmente localizável Dor localizada ou diffusa, hiperalgesia, allodinia |
Distensão visceral Associação com inflamação localizada |
| Neuropática
- Causalgia (neuralgia, lesões do SNC, ...) - Funcional (FM, síndromes talâmicas, ...) |
Dor profunda e difusa, hiperalgesia, allodinia |
Desregulação dos mecanismos excitatórios e inibitórios do SNC |
Vias nociceptivas
[editar | editar código-fonte]
(baseado em ScoreUSMLE (2015)[2])
De maneira a compreender a fisiologia da dor, a forma mais fácil é seguir as vias de sinalização nociceptiva, desde os receptores da dor até ao cérebro. É necessário despender especial atenção à integração e modulação do sinal nociceptivo nos vários níveis do SNC. Enquanto que a palavra dor se refere a um sentimento subjectivo, a palavra "nocicepção" (do latim nocere, i.e. "magoar"), refere-se ao processo sensitivo que é desencadeado. Estímulos nocivos, tais como forças mecânicas intensas ou extremos de temperatura, são detectados pelos chamados "nociceptores", que efectuam a transdução deste sinal em sinais eléctricos. Os sinais são de seguida conduzidos através de fibras aferentes primárias até ao corno posterior da medula espinhal. Aqui, os neurónios primários estabelecem sinapses com os neurónios secundários, que imediatamente decussam no interior da medula espinhal, para formar os tractos espinotalâmicos e espinoreticular. Através destes tractos, as projecções são enviadas para o tálamo, onde as fibras aferentes estabelecem uma segunda sinapse. O neurónio terciário projecta o seu axónio para o córtex somatosensorial, que está envolvido na qualidade sensitiva da dor, incluindo a sua intensidade, duração e localização.
Da periferia ao SNC
[editar | editar código-fonte]
(baseado em Hasudungan (2013) [3])
Uma estimulação nociceptiva inicia uma cascata de eventos. Primeiro, uma série de substâncias nociceptivas proinflamatórias, incluindo potássio, bradicinina, histamina e substância P são libertadas perifericamente junto do local de lesão (Tabela 2). Estas substâncias levam a hiperalgesia, isto é, a um aumento da sensibilidade à dor que pode ser medida como um limiar de dor inferior no local e à volta da lesão.
| Substância | Fonte |
|---|---|
| Potássio (K+) | Células lesadas |
| Serotonina | Sangue (plaquetas) |
| Bradicininas | Sangue (plasma) |
| Histamina | Mastócitos |
| Prostaglandinas | Células lesadas |
| Leucotrienos | Células lesadas |
| Substância P | Nervos aferentes primários |
De seguida, os terminais nervosos livres são activados pelo estímulo nocivo. Eles efectuam a transdução de sinal e transmitem de seguida sinais eléctricos ao corno posterior da medula espinhal.

(baseado em Marchand (2008)[1])
As fibras aferentes dividem-se em três categorias: as fibras Aβ, Aδ e C. As fibras Aβ normalmente conduzem sinais não-nociceptivos, mas são aqui listadas por participar na modulação da dor, descrita mais adiante. As características das diferentes fibras aferentes estão resumidas na seguinte tabela:
| Fibras Aβ | Fibras Aδ | Fibras C | |
|---|---|---|---|
| Localização | Pele | Pele | Pele, músculos e órgãos viscerais |
| Diâmetero | 6 a 12 µm
mielinizada |
1 a 5 µm
mielinizada |
0.2 a 1.5 µm
não mielinizada |
| Condução | 35 a 75 m/s | 6 a 30 m/s | 0.5 a 3 m/s |
| Papel | Toque leve, propriocepção |
Temperatura, Nocicepção |
Nocicepção (mecânica, térmica |
O aumento do diâmetro e a presença de mielina aumentam a velocidade de condução do sinal até à medula espinhal. As fibras Aδ conduzem o sinal nociceptivo de forma relativamente rápida, razão pela qual são responsáveis pelo reflexo nociceptivo (e.g. remover rapidamente a mão de objecto quente) e pela localização precisa da dor. Em contrapartida, as fibras C possuem uma baixa velocidade de condução (não são mielinizadas e têm um diâmetro pequeno) e levam portanto a uma dor difusa, mais difícil de localizar e mais duradoura.
Neurónios secundários da medula espinhal
[editar | editar código-fonte]
(baseado em Hasudungan (2013)[3])
As fibras nervosas aferentes estabelecem um primeiro contacto sináptico com os neurónios secundários no corno posterior da medula espinhal. Por outro lado, tanto os aferentes nociceptivos como os não-nociceptivos estabelecem interacções sinápticas com uma importante rede de interneurónios excitatórios e neurotransmissores da dor, incluindo a substância P e o glutamato. Este modulam o sinal nociceptivo antes de ele ser projectado aos centros superiores do SNC. O neurónio secundário percorre a medula espinhal ao longo de duas vias principais: a via espinotalâmica e o tracto espinoreticular. Ambos estes tractos decussam para o lado contralateral da medula espinhal poucos segmentos acima do nível de entrada. Enquanto que o tracto espinotalâmico ascende directamente em direcção ao tálamo, os neurónios do tracto espinoreticular estabelecem de novo sinapses com a formação reticular antes da via continuar para o tálamo. A formação reticular é localizada no tronco encefálico e está envolvida numa grande variedade de funções, incluindo a atenção e a consciência. Assim, pensa-se que esta formação leva a alterações no nível de atenção e das reacções emocionais à dor.
Da nocicepção à dor
[editar | editar código-fonte]A dor é apenas sentida quando os sinais nociceptivos atingem o córtex. Assim, o neurónios que ascendem a medula espinhal estabelecem uma última vez sinapses no tálamo. A partir daí, neurónios terciários guiam a informação nociceptiva a diferentes estruturas corticais: o córtex somatosensorial (SI e SII) está sobretudo envolvido na discriminação sensitiva do tipo de dor, enquanto que o córtex cingulado anterior (CCA) e o córtex insular (CI) estão associados aos componentes afectivo da dor.
No córtex somatosensorial, tanto a informação nociceptiva como a sensibilidade somática "normal" convergem para as mesmas áreas. Assim, é possível processar a localização e intensidade da dor. A representação cortical do corpo é descrita em: O homúnculo de Penfield .
Modulação da percepção da dor
[editar | editar código-fonte]A dor é um fenómeno dinâmico que é percebida de forma diferente por cada ser humano. A razão para isto é que o sinal nociceptivo não é apenas transmitido para o córtex mas também modulado a múltiplos níveis no interior do SNC. Esta modulação inclui mecanismos excitatórios e inibitórios do tronco encefálico, do sistema nervoso autónomo e de representações corticais responsáveis pelos aspectos emocionais (CCA e CI) e cognitivos (SI e SII) da dor.
Neste texto, apenas os mecanismos endógenos de modulação inibitória serão discutidos. Estes terão especial importância no contexto do tratamento da dor. De maneira a melhor compreender o seu papel, devemo-nos concentrar nos três níveis de modulação no interior do SNC: (baseado em Marchand (2008)[1]):
- mecanismos espinhais que produzam analgesia local, isto é, insensibilidade à dor,
- mecanismos inibitórios descendentes, oriundos do tronco encefálico e produzindo uma inibição difusa da dor, e
- centros superiores que ou modulam os mecanismos descendentes ou mudam a percepção de dor ao reinterpretarem o sinal nocicpetivo.
Mecanismos espinhais: a teoria de gate control
[editar | editar código-fonte]A teoria de gate control foi desenvolvida por Melzack & Wall em 1965[5]. Esta teoria sugere que a dor pode ser inibida na primeira sinapse, isto é, entre as fibras aferentes primárias e os neurónios secundários ao nível da medula espinhal. Quando as fibras C disparam, eles não só transmitem o sinal nociceptivo ao neurónio secundário, como também inibem os interneurónios inibitórios. Isto é interpretado como a gate estando fechada, sendo os sinais nociceptivos os únicos que são transmitidos. No entanto, se fibras Aβ também transmitirem potencias de acção (PA), elas excitam os interneurónios inibitórios. Assim, a activação do neurónio secundário não é limitada a estímulos nociceptivos, o que é interpretado como a gate estando aberta. Dependendo da frequência relativa de PA entre as fibras C e Aβ, o sinal nociceptivo pode ser inibido.
Um exemplo bem conhecido que ilustra esta teoria é de que a dor provocada por uma pancada no cotovelo diminui se o esfregarmos. As vantagens desta técnica são a ausência de estímulos nocivos e a não utilização de fármacos, enquanto, ao mesmo tempo, leva a uma modulação imediata da dor. No entanto, mal o estímulo que activa as fibras Aβ desaparecer (isto é, quando deixar de esfregar o cotovelo), o nível de dor deixa de ser modulado.
Mecanismos descendentes inibitórios: opióides endógenos
[editar | editar código-fonte]Já há muito tempo que se sabes que o ópio e os seus derivados, tal como a morfina e a heroína, actuam como analgésicos. Nos anos 1960 e 1970, os receptores destas substâncias foram descobertos, predominantemente na substância cinzenta periaquedutal (PAG), na medula rostroventral (MRV) do tronco encefálico e na medula espinhal. Isto implica que substâncias químicas semelhantes são sintetizadas pelo sistema nervoso para modular a dor de forma endógena. A serotonina e a noradrenalina são os principais neurotransmissores do sistema inibitório descendente. Estas vias inibitórias depois recrutam interneurónios da medula espinhal para produzir uma reacção que alivia a dor, um fenómeno conhecido na literature inglesa como counter-irritation. Exemplos deste tipo de modulação não são apenas os inúmeros fármacos analgésicos, mas também a massagem, acupressão e, em certos casos, a acunpuntura. Nos últimos dois casos, o sistema endógeno é activado por dor adicional, razão pela qual estas técnicas são apenas usadas depois de se tentar outras opções da modulação da dor.
Efeitos superiores
[editar | editar código-fonte]Foi demonstrado que manipualções cognitivas como a distracção, a hipnose e uma atitude expectante influenciam a percepção da dor nos indivíduos.[6] Por outro lado, já foi também confirmado que a sugestão de um certo nível de intensidade de dor pode mudar a actividade cerebral relacionado com a percepção da dor.[7] Estes resultados apoiam a ideia de que o efeito placebo pode influenciar a performance da modulação endógena da dor.
A dor do membro fantasma
[editar | editar código-fonte]História
[editar | editar código-fonte]O fenómeno conhecido como dor do membro fantasma é conhecido desde o século XVI. Um cirurgião militar francês, de nome Ambroise Paré, foi a primeira pessoa a documentar em documentos médicos este tipo de sensação:

“Para os doentes, muito depois da amputação ter sido feita, continuam a referir dor no segmento amputado. E as queixas são exuberantes, algo digno de notar e difícil de compreender para quem nunca experienciou esta dor”. [8]
Um neurologista escocês, Charles Bell, publicou em 1830 uma descrição do fenónemo na sua obra Nervous System of the Human Body. No entanto, foi preciso esperar até 1871 até a expressão "dor do membro fantasma" ser introduzida por Silas Weir Mitchell, um cirurgião militar norte-americano. Ele foi o primeiro a fornecer uma descrição moderna da sensação "fantasma" que muitos doentes amputados experienciavam no período pós-operatório:

“Existe algo quase trágico e sinistro na noção destes milagres de membros-espíritos que assombram um número igual de pobres soldados, e de vez em quando tormentando-os... quando... a sensação da presença do membro trai o homem, e de repente o lembra da sua perda”. [8]
Diferenças entre sensação fantasma e dor do membro fantasma
[editar | editar código-fonte]A sensação e a dor fantasma estão sem dúvida interligadas. No entanto, não representam o mesmo conceito e é portanto importante distinguir uma da outra.
A sensação fantasma inclui experiências cinestésicas tais como a sensação de comprimento, diâmetro e postura do membro, sensações cinéticas tais como movimentos espontâneos ou intencionais e sensações exteroceptivas tais como formigueiro, prurido ou pressão [9]. Estas sensações podem aparecer após uma amputação, em deficiências congénitas de membros, ou quando a sensibilidade do membro desaparece, por exemplo após lesões da medula espinhal [8] . Estudos foram conduzidos e mostraram que sensações fantasma ocorrem em 90 a 98% de todos os doentes. [10] [11] [12] Um fenómeno especial e experienciado por cerca de 25 a 40% dos doentes com sensações fantasma é telescoping, a sensação de o membro fantasma retrai ao longo do tempo em direcção ao coto, até estar preso a ele ou dentro dele [12] [13]
A dor do membro fantasma é variável e pode ser descrita como uma sensação de queimadura, facada ou pulsátil, entre outras.[14] Por outro lado, sensações muito complexas de dor podem ocorrer, como por exemplo a sensação de torção do membro fantasma ou de unhas cravadas na palma da mão fantasma. [9] A maioria dos indivíduos experiencia dor fantasma após a amputação, com uma prevalência indo dos 55% aos 85%. [15][8] Em muitos casos, existe dor no coto e dor fantasma, tornando a distinção destes dois tipos de dor difícil.
Estudos também mostraram que quase todos os doentes amputados que sobre de sensação fantasma também sofrem de dor fantasma, enquanto que o oposto é raro.[8]
Epidemiologia
[editar | editar código-fonte]Ao longo das últimas décadas, muitos estudo clínico sobre dor e sensação fantasma têm sido feitos, e têm revelado algumas tendências estatísticas nos doentes que sofrem desta síndrome.
A prevalência de dor do membro fantasma varia com o nível da amputação: quanto mais alto o nível da amputação, mais a incidência de dor moderada a severa. [8] Existem também indícios de que a incidência de dor fantasma poderá ser inferior no caso de uma amputação planeada de um membro não-doloroso; isto comparado com uma perda traumática do membro ou a amputação já previamente com dor. [10] Para além disto, a dor é tipicamente reportada na porção mais distal do membro fantasma, tal como os dedos das mãos e dos pés. Tem sido especulado que isto é devido ao facto de que existe uma maior representação das porções distais dos membros no córtex somatosensorial. [11] [12] É interessante referir que a prevalência de dor fantasma no membro inferior é muito superior à prevalência encontrada para o membro superior. [8] Em relação à frequência, a dor fantasma está presente de forma contínua em certos doentes, enquanto que tende a ocorrer de forma episódica (sob a forma de ataques agudos de dor) noutros. [16] No entanto, mesmo nestes casos, pode existir uma dor contínua entre os ataques. Os ataques de dor podem durar desde alguns segundos até várias horas. Em casos raros, os ataques podem durar vários dias.[15]

A dor fantasma pode surgir poucos dias a poucas semanas após a amputação, mas também pode aparecer anos após a intervenção, provocada por cirurgias efectuadas ao coto.[15] A dor pode persistir muitos anos após a amputação. No entanto, os estudos clínicos discordam na duração total da sintomatologia. Por exemplo, estudos feitos em doentes idosos que perderam um membros por insuficiências vascular mostraram resultados diferentes comparados com amputados jovens com amputação traumática após lesão.[8] Ainda assim, várias estudos parecem traçar tendências comuns: apenas 16 % dos doentes com dor fantasma fica completamente asintomático, enquanto que 37% sobre uma redução significativa da dor. 44 % mantêm o nível de dor e, em 3% dos casos, a dor aumenta ao longo do tempo.[17] [15] Outro dado comum é que se a dor se mantiver mais de seis meses após a amputação, torna-se muito difícil de tratar. [18]
É interessante referir que muitos doentes se queixam de que a dor que existia nos membros antes da amputação persiste após a amputação do membro. Esta persistência poderá ser interpretada como uma forma de memória sensorial. [19] Relacionado com estas achados, tem sido reportado que sensações fantasma são menos comuns em crianças jovens do que em adulots. A possóvel explicação para esta observação será que as crianças novas ainda não terão tido tempo para consolidar uma imagem corporal. De facto, e isto de acordo com alguns estudos, a incidência de sensações fantasma aumenta de forma drástica com o aumento da idade da criança. [10]
De acordo com um estudo feito em 139 doentes [16], a dor fantasma pode ser desencadeada por [15] :
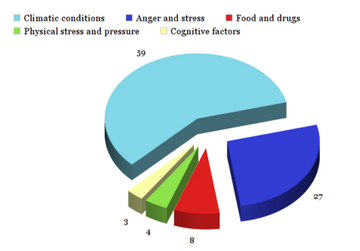
- Condições climáticas: 59%. Isto inclui 55% devido a condições meteorológicas, 1% devido à estação sazonal e 3% devido à temperatura ambiente.
- Raiva e stress: 27%
- Comida / fármacos / drogas: 8%
- Stress físico e pressão: 4%
- Factores cognitivos: 3%. Exemplos de factores cognitivos são uma atenção fixada no membro fantasma e a observação do processo de lesão.
As razões pelas quais estes factores podem desencadear dor fantasma iram ficar claras na próxima secção.
Origem da dor do membro fantasma
[editar | editar código-fonte]Em concordância com o facto de que a dor fantasma é considerada uma síndrome multifactorial de dor, as teorias actuais sobre a fisiopatologia da dor fantasma dividem os vários componentes de dor em : periférica, central e psicológica. Estas três áreas estão fortemente interconectadas.
Mecanismos periféricos
[editar | editar código-fonte]Depois da amputação, existe diferenciação celular, levando a uma degeneração da porção distal dos nervos periféricos e à formação de neuromas (tumores feitos de tecido neuronal). [20]

Os neuromas são formados pela regeneração da secção proximal do nervo e pode gerar descargas anormais que causam a persistência da dor. De facto, em vários estudos foi demonstrada a presença de hiperactividade da musculatura do coto, quando comparada com o membro contralateral.[21] [11] Esta hiperactividade estava presente sob a forma de ligeiros espasmos em pequenos grupos de fibras musculares ou sob a forma se contracções espásticas de todo o coto.
O facto de que a dor não é eliminada por bloqueio de condução dos nervos periféricos, tal como o facto de a dor poder persistir mesmo depois das descargas ectópicas dos nervos periféricos serem eliminadas por meio de fármacos ou cirurgia, sugere que a dor resulta de um processo complexo que não depende apenas no desenvolvimento de neuromas. [19] In fact, there are some additional peripheral mechanisms involved in phantom pain: blood circulation effects and sympathetic activation.
Efeitos da circulação sanguínea
[editar | editar código-fonte]Quando exposto a baixas temperaturas, o sistema nervoso simpático é estimulado, causando vasoconstrição na pele, braços e pernas.[22] Isto, por sua vez, leva a uma hipoperfusão do coto, o que pode aumentar a actividade das fibras nervosas nociceptivas e assim refoçar a sensação de dor. Isto é sobretudo devido a isquémia e a diminuição da temperatura dos neurónios.[16] Estes mecanismos vasculares são a razão pela qual um dos principais triggers de dor são as condições meteorológicas.
Por outro lado, a conexão entre curtos e fortes aumentos da tensão muscular no coto e o aparecimento subsequente de episódios de dor foi estabelecido em vários estudos. [22] A pressão mecânica e uma contracção muscular forte também têm efeitos na perfusão, o que por sua vez pode agravar a dor. Para além disto, certos alimentos (como café) ou fármacos também podem alterar a perfusão tecidular, explicando que possam provocar ataques de dor.
Activação simpática
[editar | editar código-fonte]Dentro dos neuromas, terminais nervosos eferentes ficam entrelaçados com fibras nociceptivas aferentes, resultando em interacções directas entre ambos e num aumento da actividade simpática, com agravamento da dor. [23]
Factores do SNC
[editar | editar código-fonte]Tal como foi explicado anteriormente, a dor fanstasma não é meramente causada por mecanismos periféricos. A complexidade das sensações dentro de um membro fantasma também sugerem que estas envolvam estruturas nervosas hierarquicamente superiores.[9]
A teoria da neuromatriz
[editar | editar código-fonte]A principal teoria que tenta explicar a dor fantasma no contexto do SNC é a teoria da neuromatriz. A neuromatriz inclui córtex, especialmente o somatosensorial primário e o córtex parietal posterior, o tálamo e o sistema límbico.

Esta teoria postula que a representação do corpo dentro do sistema nervoso está constantemente a ser modificada por inputs sensoriais, criando uma "neuroassinatura". Ao remover uma porção do corpo, a persistência da neuromatriz cria sensações indolores no membro fantasma, enquanto que a dor provém de uma reorganização anormal dentro da neuromatrix. Mais especificamente, a neuromatriz continua a enviar um sinal mesmo após a amputação, e a alteração destes sinais pode ser responsável por dor. Em teoria, é possível diminuir a dor eliminando este sinal emitido pela neuromatriz, ou criando um sinal de retorno normal através de estimulação eléctrica. De facto, alguns estudos indicam que a dor fantasma poderá estar ligada à actividade neuronal e à função da representação talâmica do membro amputado. Isto é reforçado pelo facto de que a microestimulação do tálamo ventrocaudal reproduz uma sensação dolorosa no membro fantasma.[19]
Enquanto que a hipótese da neuromatriz pode ser útil para descrever a origem da dor, esta não explica por que razão o alívio da sensação fantasma raramente diminui a dor fantasma, por que razão a sensação pode de repente desaparecer, ou por que razão nem todos os doentes amputados sentem dor.[19] Therefore, other possible explanations must be taken into consideration.
Hiperreactividade central
[editar | editar código-fonte]Vários estudos demonstraram que, após amputações e outros tipos de danos neuronais, um estado de hiperreactividade pode ocorrer. [21] [11]
Reorganização cortical
[editar | editar código-fonte]Para além da hiperreactividade, e possivelmente como consequência desta, são observadas alterações na representação cortical do corpo após a amputação. Estas alterações são geralmente observadas após desaferentação, e são particularmente pronunciada no córtex somatosensorial primário.

Vários estudos, feitos em primatas e em humanos, demonstraram que meses após uma amputação, a representação no córtex somatosensorial primário dos segmentos corporais adjacentes ao membro amputado terá expandido e aumentado de alguns milímetros, ocupando a quase totalidade do território do membro amputado. [24] [25] [26] [27] É de notar que a área na qual esta reorganização ocorre é mais variável nas amputações de membros inferiores. Esta reorganização cortical pode até ser observada como shifts temporários em contexto de uma anestesia local. [28] [29] e também como consequência de treine intensivo de um segmento corporal. [30] Também ocorre no córtex motor, provavelmente como resultado das fortes conexões entre córtex somatosensorial e córtex motor.[31] [32] Visto de forma intuitiva, pode ser especulado que este rearranjo seria benéfico, visto que uma área não utilizada do córtex é reaproveitada para um segmento corporal não amputado, eliminando assim o membro perdido do esquema corporal e reduzindo a dor fantasma. Contudo, esta reorganização vem com um custo e já se correlaciona a extensão da reorganização cortical e a intensidade da dor fantasma. [27] [33] Estes resultados têm levado à ideia de que o fenómeno de reorganização cortical é na realidade um fenómeno de plasticidade maladaptativa e uma das causa de dor do membro fantasma.[34]
A reorganização cortical é mediado por três mecanismos fundamentais:
a) Processos corticais
[editar | editar código-fonte]Para uma reorganização de curto-prazo, o mecanismo principal é a descoberta de conexões existentes e latentes entre duas áreas adjacentes. [29] Assume-se que este processo é desencadeado por uma mudança no equilíbrio entre o influxo excitatório e inibitório. [35] [28] No entanto, para processos que reorganização de longo prazo, novas conexões neuronais são formadas. Assim, neste caso, existem alterações estruturais que têm lugar, para além das funcionais. [16]
b) Processos espinhais
[editar | editar código-fonte]No caso de forte ou prolongada estimulação nociceptiva, a sensibilização previamente mencionada pode ocorrer também nos neurónios do corno posterior da medula espinhal. Isto pode levar a um aumento da actividade espontânea e a uma aumento da reactividade a estímulos não-nocivos [36] [37], prolongando assim a dor muito depois de o processo nocivo deixar de estar presente.
Até agora, todos os achados sobre alterações na medula espinhal devidas a amputação têm sido reportados a partir de experiências em animais. Estes indicam que fibras aferentes vindas do coto se estendem a áreas sem aferências, dentro da medula espinhal e do tronco encefálico. [38] [8]
O conhecimento que possuímos sobre o papel dos neurónios da medula espinhal na geração de dor também foi obtido pelo estudo de vítimas de queimaduras. Estes estudos indicam que, após uma queimadura, os neurónios da medula espinhal aumentam a sua frequência de potenciais de acção, resultando em hiperexcitabilidade do neurónio. Esta hiperexcitabilidade não foi afectada por bloqueios anestésicos locais na zona lesionada. Isto parece indicar que uma sensibilização ou "memória da dor" já terá sido criada. Transpondo este conhecimento para a prática clínica, isto sugere que um bloqueio da medula espinhal antes ou durante uma amputação cirúrgica poderá ajudar a prevenir este processo de sensibilização na medula espinhal. [19]
Doentes com lesão espinhal completa também podem experienciar dor fantasma, indicando que, para além dos processos espinhais e periféricos, também alterações no sistema nervoso central podem estar envolvidos na geração de dor.[8]
c) Processos talâmicos
[editar | editar código-fonte]Para além de experiências de estimulação cerebral profunda, que têm revelado as contribuições do tálamo para a dor fantasma, pouco se sabe sobre o papel que o tálamo desempenha neste contexto. Experiências feitas em animais sob anestesia local têm reportado uma reorganização de curto-prazo e reversível da representação talâmica de partes corporais. [39]
Factores psicológicos
[editar | editar código-fonte]Tanto o stres como o sentimento de raiva são considerados factores desencadeantes de dor fantasma, tal como foi discutido na secção acima sobre epidemiologia. De facto, num estudo em particular, uma correlação positiva entre stress e dor fantasma foi reportada em 74% dos doentes.[16] Isto é provavelmente devido ao facto de que tanto o stress psicológico como o físico tem um efeito nociceptivo que envolve vários processos, tais como a activação simpática, a vasoconstrição e aumento da tensão muscular, que são processos desencadeantes de dor. Muitos doentes também reportam que a dor fantasma pode ser aumentada ou desencadeada de forma consciente e diminuída através de mecanismos de distracção.[9] [10]
Tratamento da dor fantasma
[editar | editar código-fonte]A dor do membro fantasma continua sem tratamento efectivo. Algumas das abordagens usadas são analgésicos (com efeito limitado), neurolépticos, antidepressivos, bloqueios nervosos, estimulação do sistema nervoso (especificamente a medula espinhal e os nervos do coto, mas também estimulação cerebral profunda), terapia com vibração e massagem do coto, aplicação de calor, biofeedback e acunpuntura. Em alguns casos, o tecido cicatricial envolvendo o nervo é removido cirgurgicamente.[40] [41] Uma outra opção terapêutica algo popular é o uso de um espelho que permite ao doente "ver" o membro fantasma, ao observar o reflexo do outro membro. Tal como as outras abordagens terapêuticas, não é uma terapia efectiva e muitos doentes são tratados sem sucesso. De facto, 40% dos doentes não beneficiam da terapia com espelhos.[42]
Bibliografia
[editar | editar código-fonte]- ↑ 1,0 1,1 1,2 1,3 Marchand, S. (2008), ‘The physiology of pain mechanisms: From the periphery to the brain’, Rheumatic Disease Clinics of North America 34(2), 285-309.
- ↑ ScoreUSMLE (2015), ‘Spinal pathways made super easy (part 1-2)’, Youtube Video, (accessed 21.7.2015).
- ↑ 3,0 3,1 Hasudungan, A. (2013), ‘Nociceptors - an introduction to pain’ (Explains the ascending pathway, very easy to understand), Youtube Video, (accessed 21.7.2015).
- ↑ Patel, N. B. (2010), ‘Physiology of pain’, Extracted from Kopf and Patel (Ed) „Guide to Pain Management in Low-Resource Settings“, 2010, International Association for the Study of Pain.
- ↑ Melzack, R. & Wall, P. D. (1965), ‘Pain mechanisms: a new theory’, Science 150, 971--979.
- ↑ Apkarian, A. V., Bushnell, M. C., Treede, R. D. & Zubieta, J. K. (2005), ‘Human brain mechanisms for pain perception and regulation in health and disease’, European Journal of Pain 9(4), 463-484.
- ↑ Goffaux, P., Redmond, W. J., Rainville, P. & Marchand, S. (2007), ‘De- scending analgesia – when the spine echoes what the brain expects’, Pain 130(1-2), 137-143.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 C. M. Kooijman, P. U. Dijkstra, J. H. B. Geertzen, A. Elzinga, and C. P. Van Der Schans, “Phantom pain and phantom sensations in upper limb amputees: An epidemiological study,” Pain, vol. 87, no. 1, pp. 33–41, 2000.
- ↑ 9,0 9,1 9,2 9,3 P. Jensen, T.S. & Rasmussen, Phantom pain and other phenomena, Textbook o. Edinburgh: Churchill Livingstone, 1994.
- ↑ 10,0 10,1 10,2 10,3 10,4 V. S. Ramachandran and W. Hirstein, “The perception of phantom limbs. The D. O. Hebb lecture,” Brain, vol. 121, no. 9, pp. 1603–1630, 1998.
- ↑ 11,0 11,1 11,2 11,3 B. Cronholm, Phantom limbs in amputees: a study of changes in the integration of centripetal impulses with special reference to referred sensations. Stockholm, 1951.
- ↑ 12,0 12,1 12,2 E. Frank, B. & Lorenzoni, “Phantomerleben und Phantomschmerz. Fortschritte der Neurologie und Psychiatrie,” vol. 60, pp. 74–85, 1992.
- ↑ L. Schmalzl, “‘Pulling telescoped phantoms out of the stump’: Manipulating the perceived position of phantom limbs using a full-body illusion,” Front. Hum. Neurosci., vol. 5, no. November, pp. 1–12, 2011
- ↑ K. Sherman, R.A., Katz, J., Marbach, J.J. & Heermann-Do, Locations, characteristics, and descriptions. New York: Plenum Press, 1997.
- ↑ 15,0 15,1 15,2 15,3 15,4 M. Döbler, K. & Zenz, “Stumpf- und Phantomschmerz,” in Lehrbuch der Schmerztherapie, Stuttgart: Wissenschaftliche Verlagsgesellschaft, 1993, pp. 377–384.
- ↑ 16,0 16,1 16,2 16,3 16,4 C. Winter-Barnstedt, “Phantomschmerz nach Extremitätenamputation : Diagnostik und Biofeedback-Behandlung,” Ruprecht-Karls-Universität Heidelberg, 2001.
- ↑ S. W. Wartan, W. Hamann, J. R. Wedley, and I. McColl, “Phantom pain and sensation among British veteran amputees.,” Br. J. Anaesth., vol. 78, pp. 652–659, 1997.
- ↑ C. Sherman, RA, Sherman, “Prevalence and characteristics of chronic phantom limb pain among American veterans: results of a trial survey,” Am. J. Phys. Med., vol. 62, no. 5, pp. 227–238, 1983.
- ↑ 19,0 19,1 19,2 19,3 19,4 R. G. Bittar, S. Otero, H. Carter, and T. Z. Aziz, “Deep brain stimulation for phantom limb pain.,” J. Clin. Neurosci., vol. 12, no. 4, pp. 399–404, 2005.
- ↑ “Neuroma,” Wikipedia, 2016. [Online]. Available: Neuroma [Accessed: 05-Jun-2016].
- ↑ 21,0 21,1 W. Larbig, P. Montoya, H. Flor, H. Bilow, S. Weller, and N. Birbaumer, “Evidence for a change in neural processing in phantom limb pain patients.,” Pain, vol. 67, no. 2–3, pp. 275–283, 1996.
- ↑ 22,0 22,1 R. A. Sherman, V. D. Griffin, C. B. Evans, and A. S. Grana, “Temporal relationships between changes in phantom limb pain intensity and changes in surface electromyogram of the residual limb,” Int. J. Psychophysiol., vol. 13, no. 1, pp. 71–77, 1992.
- ↑ R. A. Sherman, J. G. Arena, C. J. Sherman, and J. L. Ernst, “The mystery of phantom pain: Growing evidence for psychophysiological mechanisms,” Biofeedback Self. Regul., vol. 14, no. 4, pp. 267–280, 1989
- ↑ M. M. Merzenich, R. J. Nelson, M. P. Stryker, M. S. Cynader, A. Schoppmann, and J. M. Zook, “Somatosensory cortical map changes following digit amputation in adult monkeys.,” J. Comp. Neurol., vol. 224, no. 4, pp. 591–605, 1984.
- ↑ T. P. Pons, E. G. Preston, A. K. Ommaya, H. K. Jon, E. Taub, and M. Mishkin, “Massive Cortical Reorganization After Sensory Deafferentation in Adult Macaques,” Science (80-. )., vol. 252, no. 5014, pp. 1857–1860, 1991.
- ↑ T. Elbert, H. Flor, N. Birbaumer, S. Knecht, S. Hampson, W. Larbig, and E. Taub, “Extensive reorganization of the somatosensory cortex in adult humans after nervous system injury.,” Neuroreport, vol. 5, no. 18, pp. 2593–2597, 1994.
- ↑ 27,0 27,1 H. Flor, T. Elbert, S. Knecht, C. Wienbruch, C. Pantev, N. Birbaumer, W. Larbig, and E. Taub, “Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation.,” Nature, vol. 375, no. 6531, pp. 482–484, 1995.
- ↑ 28,0 28,1 H. Buchner, C. Kauert, and I. Radermacher, “Short-term changes of finger representation at the somatosensory cortex in humans,” Neurosci. Lett., vol. 198, no. 1, pp. 57–59, 1995.
- ↑ 29,0 29,1 P. M. Rossini, G. Martino, L. Narici, A. Pasquarelli, M. Peresson, V. Pizzella, F. Tecchio, G. Torrioli, and G. L. Romani, “Short-term brain ‘plasticity’ in humans: transient finger representation changes in sensory cortex somatotopy following ischemic anesthesia,” Brain Res., vol. 642, no. 1–2, pp. 169–177, 1994.
- ↑ W. M. Jenkins, M. M. Merzenich, M. T. Ochs, T. Allard, and E. Guic-Robles, “Functional reorganization of primary somatosensory cortex in adult owl monkeys after behaviorally controlled tactile stimulation,” J. Neurophysiol., vol. 63, no. 1, pp. 82–104, 1990.
- ↑ A. Karl, N. Birbaumer, W. Lutzenberger, L. G. Cohen, and H. Flor, “Reorganization of motor and somatosensory cortex in upper extremity amputees with phantom limb pain.,” J. Neurosci., vol. 21, no. 10, pp. 3609–18, 2001.
- ↑ R. Chen, B. Corwell, Z. Yaseen, M. Hallett, and L. G. Cohen, “Mechanisms of cortical reorganization in lower-limb amputees.,” J. Neurosci., vol. 18, no. 9, pp. 3443–50, 1998.
- ↑ H. Flor, T. Elbert, W. Mühlnickel, C. Pantev, C. Wienbruch, and E. Taub, “Cortical reorganization and phantom phenomena in congenital and traumatic upper-extremity amputees,” Exp. Brain Res., vol. 119, no. 2, pp. 205–212, 1998.
- ↑ E. a Franz and V. S. Ramachandran, “Bimanual coupling in amputees with phantom limbs.,” Nat. Neurosci., vol. 1, no. 6, pp. 443–444, 1998.
- ↑ M. Calford and R. Tweedale, “Immediate and chronic changes in responses of somatosensory cortex in adult flying-fox after digit amputation.,” Nature, vol. 332, no. 6163. pp. 446–448, 1988.
- ↑ L. Arendt-Nielsen and S. Petersen-Felix, “Wind-up and neuroplasticity: is there a correlation to clinical pain?,” Eur. J. Anaesthesiol. Suppl., vol. 10, pp. 1–7, 1995.
- ↑ J. Li, D. A. Simone, and A. A. Larson, “Windup leads to characteristics of central sensitization,” Pain, vol. 79, no. 1, pp. 75–82, 1999.
- ↑ S. L. Florence and J. H. Kaas, “Large-scale reorganization at multiple levels of the somatosensory pathway follows therapeutic amputation of the hand in monkeys.,” J. Neurosci., vol. 15, no. 12, pp. 8083–8095, 1995.
- ↑ M. A. Nicolelis, R. C. Lin, D. J. Woodward, and J. K. Chapin, “Induction of immediate spatiotemporal changes in thalamic networks by peripheral block of ascending cutaneous information.,” Nature, vol. 361, no. 6412, pp. 533–6, 1993.
- ↑ “Phantom limb,” Wikipedia, 2016. [Online]. Available: w: Phantom_limb Phantom_limb [Accessed: 05-Jun-2016].
- ↑ “Pain Management Health Center,” WebMD, 2015. [Online]. Available: phantom-limb-pain| [Accessed: 05-May-2016].
- ↑ J. Foell, R. Bekrater-Bodmann, M. Diers, and H. Flor, “Mirror therapy for phantom limb pain: Brain changes and the role of body representation.,” Eur. J. Pain, pp. 1–11, 2013.


