Química inorgânica/Introdução/Íons e a regra do octeto/Número de oxidação
O número de oxidação (NOX) é a quantidade de elétrons que um átomo necessita para atingir sua estabilidade, aliado à eletronegatividade dos átomos que o estabiliza. Além disto, o número de oxidação indica a presença de polos em moléculas. Matematicamente, o número de oxidação pode ser descrito:
Considerando:
- e-v a quantidade de elétrons situados na camada de valência;
- e-e o número de elétrons necessários para o átomo se estabilizar;
- e-c o número de elétrons que são compartilhados com átomos mais eletronegativos.
Considere também:
- Se o átomo em questão é um metal, e-c não existirá, já que metais não compartilham elétrons;
- Se a substância é simples, o NOX é igual zero;
- Se um átomo de um elemento x se liga a um átomo também do elemento x, deve-se somar a quantidade de ligações que estes fazem entre si ao valor do NOX.
Além disto, podemos considerar que em compostos estáveis, não devem faltar (nos ametais) ou sobrar (nos metais) elétrons. Logo:
Senão, não ocorre estabilidade.
Para determinar o número de oxidação dos átomos de um composto, deve-se inciar pelos átomos mais eletronegativos e pelos metais se estiver explicita sua valência.
 Exemplos[editar | editar código-fonte]
Exemplos[editar | editar código-fonte]
Para calcular o NOX, deve-se ter em mente a eletronegatividade dos ametais, que cresce no sentido da seta:
Iniciaremos pelo átomo mais eletronegativo, o flúor. Como não há elemento mais eletronegativo que este último, este não possuirá valor para e-c. Assim, NOX = e-v - e-e = 7 - 8 = -1.
O segundo átomo mais eletronegativo é o oxigênio. O oxigênio forma uma ligação covalente simples com um átomo que é mais eletronegativo que ele mesmo (o flúor), então, NOX = 6 - 8 + 2 x 1 = 0:
Por fim, o átomo de hidrogênio faz uma ligação covalente simples com um átomo mais eletronegativo (o oxigênio). Assim, NOX = 1 - 2 + 2 x 1 = 1:
Observe que a soma dos NOX resulta em zero, o que prova a estabilidade do FOH.
Como há um metal, o sódio, seu NOX será 1 - 0 = 1. O oxigênio, que é o mais eletronegativo, tem seu NOX = 6 - 8 = -2:
E por último, o átomo de cloro faz uma ligação simples com um átomo que é mais eletronegativo (o oxigênio). Então, seu NOX = 7 - 8 + 2 x 1 = 1:
Analisando a fórmula estrutural do trióxidano, vemos que o átomo de oxigênio central liga-se a outros átomos de oxigênio, portanto devemos somar a quantidade de ligações que ele faz com os demais oxigênios ao NOX. Então, NOX = 6 - 8 + 2 = 0.
Os demais átomos de oxigênio fazem uma ligação simples com o átomo central, então têm NOX = 6 - 8 + 1 = -1.
Os dois átomos de hidrogênio ligam-se a átomos eletronegativos, logo, seus números de oxidação são 1 - 2 + 2 x 1 = 1.
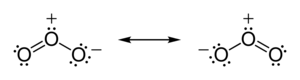
O ozônio é um composto em que o átomo de oxigênio central encontra-se com excesso de carga. Quanto aos átomos das extremidades, ora o primeiro está estável e para o terceiro falta um compartilhamento, ora ao contrário (ressonância). As estruturas de Lewis do ozônio são as seguintes:
Utilizaremos o NOX para provar a estabilidade, sendo que a soma dos números de oxidação de cada átomo deve ser igual a zero. Partindo do átomo de oxigênio central, o NOX = 6 - 8 + 3 = 1. O átomo com falta de carga, apresenta NOX = 6 - 8 + 1 = -1. Observe que, independentemente da falta ou excesso de cargas, a fórmula do NOX não muda. O que faz os números de oxidação serem diferentes é o número de elétrons compartilhados. Por fim, o átomo restante, apresenta NOX = 6 - 8 + 2 = 0. A soma dos NOX = 1 + (-1) + 0 = 0, o que comprova a estabilidade.
Como o lítio é um metal, seu NOX = 1 - 0 = 1. Já o flúor, que é o átomo mais eletronegativo, 7 - 8 = -1. O cloro, que não tem ligações com átomos mais eletronegativos, possui NOX = 7 - 8 = -1:
O oxigênio e o carbono fazem, cada um, uma ligação simples com átomos mais eletronegativos. Enquanto o NOX do carbono é 4 - 8 + 2 x 1 = -2, o do oxigênio é 6 - 8 + 2 x 1 = 0:
Na sequência, temos o hidrogênio e o silício. O hidrogênio faz uma ligação simples com um átomo mais eletronegativo, assim, seu número de oxidação é 1 - 2 + 2 x 1 = +1. O silício faz uma ligação simples com um átomo mais eletronegativo (oxigênio) e uma dupla com um átomo mais eletronegativo (carbono). Logo, seu NOX = 4 - 8 + 2 x (1 + 2) = +2: