Bioquímica/Monossacarídeos
Monossacarídeos[editar | editar código-fonte]

Os monossacarídeos, ou monossacáridos, são os glícidos mais simples. São constituídos por cadeias de carbono hidroxiladas, com a presença de grupos carbonila. A posição do grupo carbonila na cadeia permite distinguir duas famílias de monossacarídeos: as aldoses e as cetoses. As aldoses possuem o grupo carbonila na extremidade da cadeia de carbono (sendo então um grupo aldeído) e as cetoses possuem o grupo carbonilo num outro carbono, que não numa extremidade (sendo então um grupo cetona).
Fisicamente, são substâncias cristalinas, incolores, geralmente de sabor adocicado. São solúveis em água e insolúveis em solventes apolares. A assimetria de distribuição de grupos carbonila e hidroxila ao longo da cadeia leva à existência de diversos centros quirais, pelo que os monossacarídeos apresentam uma estereoquímica complexa.
Os monossacarídeos mais comuns possuem de três a sete carbonos na sua cadeia principal. Em solução aquosa, os monossacarídeos com cinco ou seis átomos de carbono tendem a formar estruturas cíclicas.
Nomenclatura[editar | editar código-fonte]
Os monossacarídeos podem ser genericamente designados pela família a que pertencem e quanto ao número de carbonos da sua cadeia. Assim, monossacarídeos com três carbonos são trioses, com quatro carbonos tetroses, tendo-se pentoses, hexoses e heptoses se possuírem cinco, seis ou sete átomos de carbono, respectivamente. É acrescentado o prefixo "aldo" ou o prefixo "ceto" conforme a sua família das aldoses ou das cetoses, respectivamente. Pode ter-se então, por exemplo, aldotrioses, aldopentoses, ceto-hexoses, etc. Note-se a presença do sufixo "-ose", comum aos oligossacarídeos (que por vezes são também designados simplesmente "oses").
Alguns dos monossacarídeos mais representativos encontram-se na figura abaixo. Dentre estes, destaque-se a D-glucose (uma aldo-hexose), a D-frutose (uma ceto-hexose) e o D-gliceraldeído (uma aldotriose).
-
D-manitol (aldo-hexose)
-
D-xilose (aldopentose)
-
L-frutose (ceto-hexose)
-
D-gliceraldeído (aldotriose)
-
D-ribulose (cetopentose)
-
D-fucose (aldo-hexose)
Quiralidade e fórmula de Fischer[editar | editar código-fonte]
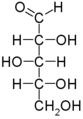
Exceto a di-hidroxiacetona, todos os monossacarídeos possuem átomos de carbono quirais, ou seja, em que os quatros grupos diretamente ligados ao carbono são diferentes, podendo então apresentar diferentes conformações. O gliceraldeído possui apenas um centro quiral, apresentando dois possíveis enantiômeros, designados D-gliceraldeído e L-gliceraldeído. Ao desenhar a fórmula estrutural do gliceraldeído no papel, é possível fazê-lo de duas formas fundamentalmente diferentes: colocando o grupo aldeído no topo e o carbono não-quiral no extremo oposto, o grupo hidroxilo pode ser colocado do lado direito (isômero D) ou do lado esquerdo (isômero L).
-
Projeção de Fischer do D-gliceraldeído.
-
Projeção de Fischer do L-gliceraldeído.
Esta forma de representação da fórmula estrutural é conhecida como fórmula de projeção de Fischer, ou mais simplesmente fórmula de Fischer. A disposição dos átomos no plano não é aleatória: assume-se que as ligações químicas desenhadas na vertical estão atrás do plano do desenho, enquanto que as ligações químicas desenhadas horizontalmente estão projetadas acima desse plano. As moléculas são representadas com o grupo carbonilo o mais próximo possível do topo.
A fórmula de Fischer permite comparar de forma simples estruturas de monossacarídeos entre si e com o gliceraldeído. Considerando-se o centro quiral mais distante do grupo carbonilo, compara-se a posição do grupo -OH nesse carbono com a posição do grupo -OH nos diferentes enantiômeros de gliceraldeído: atribui-se então a nomenclatura D- e L- conforme a semelhança com o respectivo enantiômero do gliceraldeído. Uma molécula com n centros quirais terá 2n estereoisômeros; por exemplo, existem dezasseis aldo-hexoses, sendo oito enantiômeros L- e oito D-. No entanto, a maioria das aldo-hexoses encontradas em sistemas vivos são D-hexoses.
Os carbonos da cadeia dos monossacarídeos são numerados seguindo a nomenclatura clássica da Química Orgânica, começando-se no carbono mais próximo do grupo de maior prioridade. Neste caso, tal grupo é o carbonilo. Cada estereoisômero tem, no entanto, um nome trivial: têm-se a D-glucose, a D-manose, a D-galactose como as aldo-hexoses mais importantes, existindo outras como a D-talose ou a D-gulose, por exemplo. As tetracetoses e as pentacetoses obtêm o seu nome a partir das tetra-aldoses e penta-aldoses correspondentes, inserindo a partícula "ul" no meio no nome: por exemplo, a D-ribulose é a cetose correspondente à aldose D-ribose e a D-xilulose é a cetose correspondente à aldose D-xilose.
Alguns monossacarídeos são muito semelhantes, diferindo apenas na conformação quiral de um carbono; tais pares de monossacarídeos são chamados epímeros. A D-glucose e a D-galactose são um exemplo.
Estrutura cíclica[editar | editar código-fonte]
A representação estrutural de Fischer é útil para a distinção de enantiômeros, mas na realidade os monossacarídeos adotam uma conformação cíclica quando em solução aquosa. Tal conformação ocorre através da ligação covalente do grupo carbonilo com um dos grupos hidroxilo da própria molécula. Esta reação ocorre com as aldotetroses e com todos os monossacarídeos com cinco ou mais átomos de carbono.
A reação de um grupo carbonilo com um grupo hidroxilo resulta na formação de compostos conhecidos como hemiacetais (se o grupo carbonilo é um aldeído) ou hemicetais (se o grupo carbonilo é uma cetona). As aldo-hexoses podem formar através desta reação anéis de cinco ou seis membros, conforme o grupo hidroxilo com que o aldeído reage. Pela sua semelhança aos compostos orgânicos furano e pirano, as aldo-hexoses que formam compostos cíclicos são denominadas furanoses e piranoses, com estrutura em anel de cinco e seis membros, respectivamente. As piranoses são, no entanto, mais estáveis em solução e constituem a forma predominante em organismos vivos.
Após a reação que forma o hemiacetal ou o hemicetal, podem existir diferentes posições do grupo -OH formado nesta reação pela redução do carbonilo. Estes diferentes isômeros são denominados anômeros, podendo interconverter-se em solução numa reação chamada de mutarrotação.
Fórmulas de Haworth e fórmulas conformacionais[editar | editar código-fonte]
Para maior clareza sobre a estrutura e, principalmente, sobre a estereoquímica das furanoses e piranoses, é comum usar-se a fórmula de perspectiva de Haworth. Nesta, o anel é colocado de forma semelhante à do pirano ou do furano, mas com um dos lados traçado de forma mais espessa, para demonstrar perspectiva (esse lado estará mais próximo do leitor). Visualiza-se então um plano formado pelo anel, acima e abaixo do qual se projetam os restantes grupos; os que estão acima do anel estariam no lado esquerdo numa projeção de Fischer.

No entanto, o anel não é planar, como pode ser sugerido pela fórmula de perspectiva de Haworth. Tais anéis tendem a tomar uma de duas conformações, devido à repulsão das nuvens eletrônicas dos átomos dos grupos ligados à cadeia principal: conformação em cadeira e conformação em barco, sendo a conformação em cadeira a de menor energia (menor repulsão entre as nuvens eletrônicas).
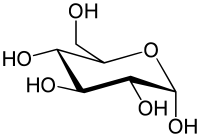
Existe conversão entre as duas conformações em solução aquosa.